L’attivazione costitutiva dell’asse TLR4-IRAK1-NF-κB è coinvolta nella risposta precoce dell’inflammasoma NLRP3 nelle cellule mononucleate del sangue periferico di pazienti con sindrome di Rett
Valeria Cordonea, Francesca Ferrarab, Alessandra Pecorellic, Anna Guiottoa, Antonio Vitaled, Fernanda Amicarellie, Carlo Cervellatif, JoussefHayekg, Giuseppe Valacchia,c,h,*
aDept. of Environment and Prevention, University of Ferrara, 44121, Ferrara, Italy. bDept. of Neuroscience and Rehabilitation, University of Ferrara, 44121, Ferrara, Italy.cAnimal Science Department, Plants for Human Health Institute, N.C. Research Campus, North Carolina State University, 28081, Kannapolis, NC, USA.dPaediatric Unit, “San Giuseppe Moscati” National Hospital (AORN), 83100, Avellino, Italy.eDept. of Life, Health and Environmental Sciences, University of L’Aquila, 67100, L’Aquila, Italy.fDept. of Morphology, Surgery and Experimental Medicine, University of Ferrara, 44121, Ferrara, Italy.gToscana Life Science Foundation, 53100, Siena, Italy.hDept. of Food and Nutrition, Kyung Hee University, 02447, Seoul, South Korea.
Correspondence: gvalacc@ncsu.edu.
La sindrome di Rett (RTT; OMIM #312750) è un disturbo dello sviluppo neurologico con una componente genetica caratterizzata da mutazioni a carico gene MECP2 e della corrispondente proteina[1]. Oltre a mostrare una regressione dello sviluppo neurologico, le pazienti RTT presentano molte altre manifestazioni cliniche, come disturbi respiratori, disturbi del sonno, problemi cardiaci e gastrointestinali, osteopenia e infezioni ricorrenti[2,3].Inoltre, nella RTT diversi processi metabolicirisultano compromessi (es. lo sbilancio dell’omeostasi redox, la disfunzione mitocondriale e lostato infiammatorio subclinico cronico; una condizione definita “OxInflammation”) [4].
Alla luce di ciò, il nostro progetto di ricerca si è focalizzato sullo studio del sistema dell’inflammasoma, un complesso multiproteico coinvolto principalmente nella risposta immunitaria innata, ma anche nell’interazione tra infiammazione e stress ossidativo[5].
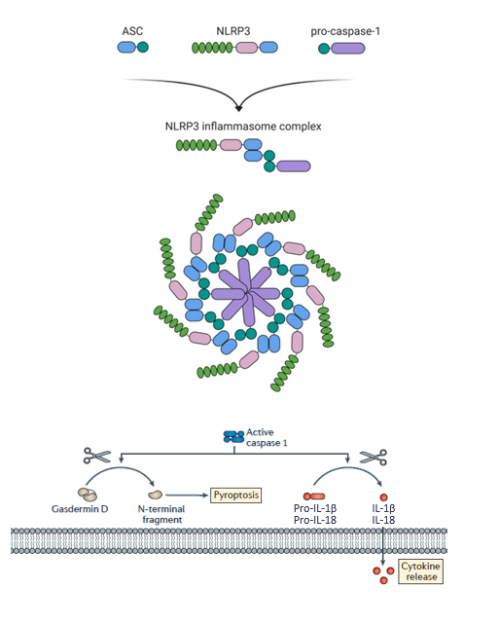
Il macchinario dell’inflammasoma è costituito da sensori intracellulari, come NLRP3, in grado di legare la proteina adattatrice ASC, che a sua volta interagisce con la proteina effettrice pro-caspasi 1. Una volta attivata, la caspasi 1 può svolgere diverse funzioni: convertire le citochine pro-infiammatorie interleuchine (IL)-1β e 18 nelle loro forme mature e tagliare una parte della proteina gasderminD, la quale può iniziare un processo di morte cellulare pro-infiammatoria, noto come piroptosi (Fig. 1) [6]. Una deregolazione dell’inflammasoma NLRP3 svolge un ruolo chiave in malattie infiammatorie, cancro, malattie metaboliche e autoimmuni, neurodegenerative e disturbi dello spettro autistico (ASD) [7–10].
I PBMC RTT hanno mostrato una maggiore produzione di specie reattive dell’ossigenoeun’attivazione costitutiva dell’asse TLR4-IRAK1-NF-κB p65, fattori cruciali nell’attivazione di una risposta pro-infiammatoria generale e a monte dell’inflammasoma. Abbiamo anche rilevato un aumento dei livelli di RNA dell’IL-18, delle proteine NLRP3 e ASC, nonché della loro interazione nei PBMC RTT, rispetto alle cellule CTR.Alcune di queste alterazioni sono connesse alla carenza di MeCP2, come dimostrato dal modello sperimentale dimonociti THP-1, in cui abbiamo silenziato il gene MECP2.Infine i nostri risultati hanno rivelato unaumento dei livelli plasmatici di IL-1β che correlano con la gravità della mutazione MECP2 e, cosa ancor più interessante, un aumento dei livelli circolanti di IL-18 che invece correlano negativamente con lo stadio della patologia, cioè sono maggiori nello stadio 2.Sulla basedi un nostro precedente lavoro, effettuato su fibroblasti primari provenienti da individui di controllo (CTR) e RTT [11], e del potenziale ruolo del sistema inflammasoma nel perpetuare lo stato di OxInflammationtipico della patologia, lo scopo di questo lavoro è sato quello di studiare lo stato di attivazione dei componenti dell’inflammasoma in un modello di cellule immunocompetenti, come le cellule mononucleate del sangue periferico (linfociti e monociti, alias PBMC), e in campioni di plasma, entrambi prelevati da 20 pazienti RTT in diversi stadi della malattia e con diverse mutazioni di MECP2.
Questo studio fornisce quindi nuove informazioni sui meccanismi coinvolti nello stato infiammatorio subclinico presente nei pazienti RTT, portando così alla luce nuovi bersagli per futuri approcci terapeutici.
Link dell’articolo: https://www.sciencedirect.com/science/article/pii/S0891584922000284?via%3Dihub
Referenze
[1] R.E. Amir, I.B. Van den Veyver, M. Wan, C.Q. Tran, U. Francke, H.Y. Zoghbi, Rett syndrome is caused by mutations in X-linked MECP2, encoding methyl-CpG-binding protein 2, Nat. Genet. 23 (1999) 185–188. https://doi.org/10.1038/13810.
[2] E. Borloz, L. Villard, J.-C. Roux, Rett syndrome: think outside the (skull) box, Fac Rev. 10 (2021) 59. https://doi.org/10.12703/r/10-59.
[3] J. Wang, Y. Xiao, C. Liu, Y. Huang, R.B. Petersen, L. Zheng, K. Huang, Emerging physiological and pathological roles of MeCP2 in non-neurological systems, Arch Biochem Biophys. 700 (2021) 108768. https://doi.org/10.1016/j.abb.2021.108768.
[4] A. Pecorelli, C. Cervellati, J. Hayek, G. Valacchi, OxInflammation in Rett syndrome, Int. J. Biochem. Cell Biol. 81 (2016) 246–253. https://doi.org/10.1016/j.biocel.2016.07.015.
[5] A. Abderrazak, T. Syrovets, D. Couchie, K. El Hadri, B. Friguet, T. Simmet, M. Rouis, NLRP3 inflammasome: from a danger signal sensor to a regulatory node of oxidative stress and inflammatory diseases, Redox Biol. 4 (2015) 296–307. https://doi.org/10.1016/j.redox.2015.01.008.
[6] P. Broz, V.M. Dixit, Inflammasomes: mechanism of assembly, regulation and signalling, Nat Rev Immunol. 16 (2016) 407–420. https://doi.org/10.1038/nri.2016.58.
[7] B.K. Davis, H. Wen, J.P.-Y. Ting, The inflammasome NLRs in immunity, inflammation, and associated diseases, Annu Rev Immunol. 29 (2011) 707–735. https://doi.org/10.1146/annurev-immunol-031210-101405.
[8] M. Moossavi, N. Parsamanesh, A. Bahrami, S.L. Atkin, A. Sahebkar, Role of the NLRP3 inflammasome in cancer, Mol Cancer. 17 (2018) 158. https://doi.org/10.1186/s12943-018-0900-3.
[9] M. Saresella, F. Piancone, I. Marventano, M. Zoppis, A. Hernis, M. Zanette, D. Trabattoni, M. Chiappedi, A. Ghezzo, M.P. Canevini, F. la Rosa, S. Esposito, M. Clerici, Multiple inflammasome complexes are activated in autistic spectrum disorders, Brain Behav. Immun. 57 (2016) 125–133. https://doi.org/10.1016/j.bbi.2016.03.009.
[10] M. Saresella, F. La Rosa, F. Piancone, M. Zoppis, I. Marventano, E. Calabrese, V. Rainone, R. Nemni, R. Mancuso, M. Clerici, The NLRP3 and NLRP1 inflammasomes are activated in Alzheimer’s disease, Mol Neurodegener. 11 (2016) 23. https://doi.org/10.1186/s13024-016-0088-1.
[11] A. Pecorelli, V. Cordone, N. Messano, C. Zhang, S. Falone, F. Amicarelli, J. Hayek, G. Valacchi, Altered inflammasome machinery as a key player in the perpetuation of Rett syndrome oxinflammation, Redox Biol. 28 (2020) 101334. https://doi.org/10.1016/j.redox.2019.101334.


